Depozycja płucna jest ważnym parametrem wpływającym na skuteczność leków wziewnych. Na depozycję wpływa szereg czynników, w tym wiele zależnych od siebie nawzajem, m in.: formulacja, w tym wielkość, kształt i gęstość cząstek oraz rodzaj nośnika, właściwości inhalatora warunkujące sposób tworzenia i rodzaj aerozolu, a także czynniki zależne od pacjenta, jak anatomia dróg oddechowych i przepływ wdechowy [1-5].
Jedną z podstawowych kwestii w kontekście depozycji jest wielkość cząstek. O ile najczęściej wspomina się o MMAD, czyli średnicy aerodynamicznej cząstki odpowiadającej medianie rozkładu masowego, to dla osiągnięcia pożądanej depozycji nie mniej ważne są inne parametry, takie jak frakcja drobnych cząstek (FPF) czy rozkład wielkości cząstek [4]. Za optymalne MMAD uznaje się zakres od 1 lub 1,5 do 5 µm [6,7]. Cząstki o wielkości >5 µm w większym stopniu osadzają się w jamie ustnej lub gardle [6]. Z drugiej strony, zbyt drobne cząstki w większym stopniu są usuwane z dróg oddechowych wraz z wydechem lub ulegają zwiększonej absorpcji w pęcherzykach płucnych, co może prowadzić do zwiększonego ryzyka wystąpienia systemowych działań niepożądanych [6-8]. Patrząc na wielkość cząstek z innej strony, wiele badań pokazuje bardzo duże znaczenie wysokiej FPF dla osiągnięcia pożądanej depozycji [9-11].

Z uwagi na złożony charakter depozycji, narosło wokół niej wiele mitów. Podstawowym problemem jest spłycanie zależności depozycji wyłącznie do wielkości cząstki, a w szczególności do MMAD [9,12]. Najbardziej zakorzenionym mitem w tej kategorii jest rzekoma wyższość „superdrobnych” cząstek z MMAD ok. 1 µm w porównaniu do drobnych cząstek, w zakresie 1-5 µm. Dotychczas większość danych naukowych wskazuje jednak na brak wyższości klinicznej „superdrobnych” cząstek [9,12,13]. Rozwiewanie podobnych mitów jest utrudnione przez brak odpowiednich badań porównawczych, co znalazło swój wydźwięk również w obszarze wziewnych leków trójskładnikowych wGKS/LAMA/LABA stosowanych w POChP.
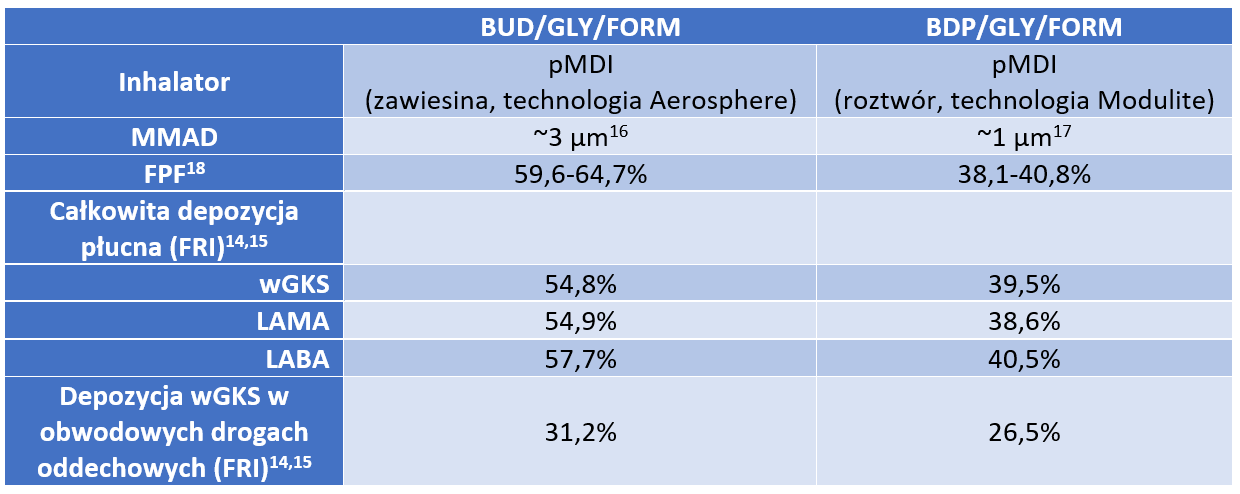
W badaniu depozycji płucnej metodą funkcjonalnego obrazowania dróg oddechowych (FRI) po raz pierwszy porównano trzy wziewne leki trójskładnikowe stosowane w POChP: BUD/GLY/FORM w pMDI, BDP/GLY/FORM w pMDI i FF/UMEC/VI w DPI* [14]. Konfrontując dwie kombinacje dostępne w inhalatorach ciśnieniowych, różniące się wielkością cząstek, wykazano około 40% większą całkowitą depozycję płucną dla wszystkich składników BUD/GLY/FORM (MMAD ~3 µm [15]) w stosunku do kombinacji BDP/GLY/FORM (MMAD ~1 µm [16])**. Depozycja wGKS w obwodowych drogach oddechowych była około 20% wyższa dla BUD/GLY/FORM w porównaniu do BDP/GLY/FORM*** [14]. Więcej na temat wyników powyższego badania znajdą Państwo w tym artykule. Dane te rozwiewają część mitów narosłych wokół wielkości cząstek leków wziewnych i jej wpływu na depozycję.
Skąd mogą wynikać takie różnice w depozycji? Przyczyny nie zostały jeszcze udowodnione, istnieje jednak kilka czynników, które mogą wyjaśniać te dane. Po pierwsze, BUD/GLY/FORM cechuje się cząstkami o MMAD ~3 µm, czyli w środkowej części zakresu uważanego za optymalny. Preparat zawierający BDP/GLY/FORM ma MMAD ~1 µm, czyli w okolicach granicy, poniżej której występuje zwiększone usuwanie cząstek z wydechem zamiast prawidłowej sedymentacji w płucach [6-8]. Po drugie, BUD/GLY/FORM posiada znacząco wyższą frakcję cząstek drobnych (FPF), która jest ważnym czynnikiem wpływającym na depozycję (FPF 59,6-64,7% vs 38,1-40,8%)† [17]. W końcu, wysoka depozycja BUD/GLY/FORM jest prawdopodobnie związana z wykorzystaniem technologii Aerosphere. Opiera się ona na zastosowaniu cząstek nośnika zbudowanych z fosfolipidów. Cząstki takie posiadają porowatą, lekką strukturę przekładającą się na korzystne właściwości aerodynamiczne, odpowiednią aerolizację i dostarczenie leku zarówno do centralnych, jak i obwodowych dróg oddechowych. Wykorzystanie fosfolipidów, będących głównym składnikiem surfaktantu płuc, zapewnia biokompatybilność nośnika i umożliwia odpowiednią absorpcję substancji leczniczych [4,18-20].
Depozycja płucna to ważny i jednocześnie złożony czynnik wpływający na skuteczność leczenia wziewnego. Jednocześnie, z uwagi na kompleksowość tego zagadnienia, na temat znaczenia poszczególnych aspektów formulacji na dostarczanie leków do dróg oddechowych powstało wiele mitów – i to pomimo licznych, przeczących im badań. Zaprezentowane porównanie depozycji leków trójskładnikowych w pMDI dostarcza wyniki zbieżne z wiedzą naukową i przyczynia się do rozwiewania wątpliwości związanych z depozycją.
*Nie ma bezpośrednich porównań in vivo depozycji płucnej terapii trójskładnikowych w jednym inhalatorze. Powyższe dane nie sugerują wyższej skuteczności ani bezpieczeństwa jednego leku nad drugim. Dane mają charakter wyłącznie opisowy. Badanie in silico przeprowadzone metodą funkcjonalnego obrazowania dróg oddechowych (FRI). Wykorzystane zostały trójwymiarowe modele dróg oddechowych 20 chorych na POChP (średni wiek 64,9 lat; średni odsetek przewidzianej FEV1 47,4%). Całkowita i regionalna depozycja płucna została wyrażona jako odsetek dawki dostarczonej BUD/GLY/FORM w inhalatorze ciśnieniowym w dawce 160/7,2/5 μg na inhalację, BDP/GLY/FORM w inhalatorze ciśnieniowym w dawce 87/9/5 μg na inhalację i FF/UMEC/VI w inhalatorze suchego proszku w dawce 100/62,5/25 μg na inhalację. Symulacje zostały wykonane przy średnim przepływie wdechowym 30 L/min. Oszacowano depozycję płucną leków trójskładnikowych dla każdego składnika z osobna.
**Całkowita depozycja płucna: budezonid/glikopironium/formoterolu fumaran (BUD/GLY/FORM) 55,8%; beklometazon/glikopironium/fumaran formoterolu (BDP/GLY/FORM) 39,5%. wGKS: 54,8% vs 39,5%; LABA: 57,7% vs 40,5%; LAMA: 54,9% vs 38,6%.
***Depozycja płucna wGKS w obwodowych drogach oddechowych: budezonid/glikopironium/formoterolu fumaran (BUD/GLY/FORM) 31,2%, beklometazon/glikopironium/fumaran formoterolu (BDP/GLY/FORM) 26,5%.
†Dane z badania in vitro. Frakcja drobnych cząstek (FPF) ± odchylenie standardowe dla BUD/GLY/FORM vs BDP/GLY/FORM w inhalatorze ciśnieniowym, mierzona 0 s po wstrząśnięciu inhalatora, n=6. wGKS: 59,6 ± 0,8% vs 39,8 ± 2,9%. LAMA: 64,7 ± 2,4% vs 38,1 ± 3,9%. LABA: 62,7 ± 2,1% vs 40,8 ± 2,8%. Drobne cząstki zdefiniowano jako cząstki ze średnicą aerodynamiczną ≤5 μm.
BDP, beklometazonu dipropionian
BUD, budezonid
DPI, inhalator suchego proszku
FF, flutykazonu furoinian
FORM, formoterol
FPF, frakcja drobnych cząstek
FRI, funkcjonalne obrazowanie dróg oddechowych
GLY, glikopironium
LABA, długo działający β2-agonista
LAMA, długo działający antagonista receptora muskarynowego
MMAD, średnica aerodynamiczna cząstki odpowiadająca medianie rozkładu masowego
pMDI, inhalator ciśnieniowy z dozownikiem
POChP, przewlekła obturacyjna choroba płuc
UMEC, umeklidynium
VI, wilanterol
wGKS, wziewny glikokortykosteroid
1. Labiris NR, Dolovich MB. Br J Clin Pharmacol. 2003;56(6):588-599.
2. Labiris NR, Dolovich MB. Br J Clin Pharmacol. 2003;56(6):600-612.
3. Shakshuki A, Agu RU. Pulm Ther. 2017;3(2):267-281.
4. Usmani OS, et al. Int J Chron Obstruct Pulmon Dis. 2021;16:113-124.
5. Carvalho TC, et al. Int J Pharm. 2011;406(1-2):1-10.
6. Demoly P, et al. Respir Med. 2014;108(8):1195-1203.
7. Gardenhire DS, et al. A guide to aerosol delivery devices for respiratory therapists (5th edition). 2023. American Association for Respiratory Care website. https://www.aarc.org/wp-content/uploads/2018/03/aersol-guides-for-rts.pdf. Data dostępu: 16.09.2024.
8. Paranjpe M, et al. Int J Mol Sci. 2014;15(4):5852-5873.
9. de Boer AH, et al. Eur J Pharm Biopharm. 2015;96:143-151.
10. Bonini M, Usmani OS. COPD Res Pract. 2015;1,9.
11. Van Holsbeke C, et al. Eur Res J. 2014;44:P912. https://erj.ersjournals.com/content/44/Suppl_58/P912. Data dostępu: 16.09.2024.
12. Rottier BL, Rubin BK. Paediatr Respir Rev. 2013;14(2):112-138.
13. El Baou C, et al. BMC Pulm Med. 2017;17(1):31.
14. Singh D i wsp. Int J Chron Obstruct Pulmon Dis. 2025 Jun 27;20:2103-2116.
15. Usmani O, et al. Respir Res. 2023;24(1):226.
16. Singh D, et al. Int J Chron Obstruct Pulmon Dis. 2017 Oct 6;12:2917-2928.
17. D'Angelo D, et al. Int J Pharm. 2023 Jan 25;631:122478.
18. Lechuga-Ballesteros D, et al. Future Med Chem 2011;3(13):1703–1718
19. Wauthoz N, Amighi K. Eur J Lipid Sci Technol. 2014; 116: 1114-1128.
20. Aktualna Charakterystyka Produktu Leczniczego Trixeo Aerosphere.