Przewlekła obturacyjna choroba płuc (POChP) to obecnie 3. przyczyna zgonów na świecie 1. Szacuje się, że każdego roku na POChP może umierać ponad 3,5 miliony ludzi 2. Zaostrzenia POChP, będące najważniejszym zdarzeniem prowadzącym do przyspieszonej progresji choroby, są również kluczowym czynnikiem zwiększonego ryzyka zgonu 3-5. Należy zaznaczyć, że u chorych na POChP do najczęstszych przyczyn zgonu, obok niewydolności oddechowej, zalicza się przede wszystkim zdarzenia sercowo-naczyniowe i raka płuca 6.
Według raportu GOLD, do głównych celów leczenia POChP należą redukcja ryzyka zaostrzeń i zgonu. Przez wiele lat udowodnioną skuteczność w zmniejszeniu ryzyka zgonu posiadały jedynie niefarmakologiczne metody leczenia, m. in. zaprzestanie palenia tytoniu, rehabilitacja pulmonologiczna czy tlenoterapia 7. Jednocześnie, kilka znaczących badań klinicznych próbowało wykazać możliwość redukcji ryzyka zgonu przy użyciu leków. Niestety, w badaniu UPLIFT nie udało się uzyskać statystycznie istotnej redukcji ryzyka zgonu, stosując tiotropium – długo działającego antagonistę receptorów muskarynowych (LAMA)* 8. Podobnie badania TORCH i SUMMIT nie osiągnęły tego punktu końcowego, odpowiednio dla kombinacji flutykazonu propionian/salmeterol** i flutykazonu furoinian/wilanterol***, czyli wziewnych glikokortykosteroidów z długo działającymi agonistami receptora β2-adrenergicznego (wGKS/LABA) 9,10. Przełomem było ogłoszenie w raporcie GOLD 2023 leków trójskładnikowych wGKS/LABA/LAMA jako pierwszej farmakoterapii pozwalającej na redukcję ryzyka zgonu u chorych na POChP 11. Zapis ten powstał w oparciu o dwa duże badania – ETHOS i IMPACT 12-15.

Zarówno w badaniu ETHOS, jak i w badaniu IMPACT, wykazano redukcję częstości umiarkowanych lub ciężkich zaostrzeń dla terapii wGKS/LABA/LAMA w porównaniu do grup LABA/LAMA i wGKS/LABA 12,13. Konsekwencją znaczącego zmniejszenia liczby zaostrzeń okazała się być redukcja ryzyka zgonu u pacjentów leczonych wGKS/LABA/LAMA w porównaniu do terapii LABA/LAMA 14,15.
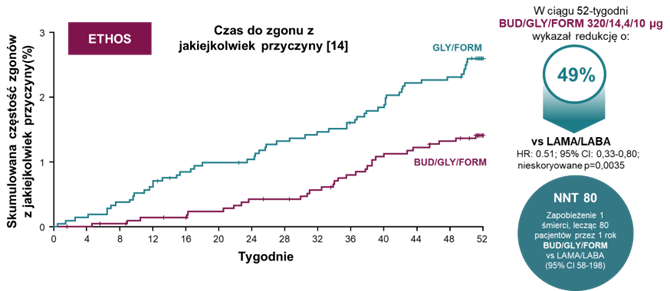
W badaniu ETHOS wykazano 49% redukcję ryzyka zgonu dla kombinacji budezonid/glikopironium/formoterol (BUD/GLY/FORM) w porównaniu do terapii glikopironium/formoterol† 14. W badaniu IMPACT pokazano 28% redukcję w grupie flutykazonu furoinian/umeklidynium/wilanterol (FF/UMEC/VI) w stosunku do połączenia umeklidynium/wilanterol†† 15. Aby zrozumieć, dlaczego te badania okazały się przełomowe, warto spojrzeć na powyższe wyniki z szerszej perspektywy. 49% redukcja ryzyka zgonu w badaniu ETHOS przekłada się na liczbę pacjentów, których należy poddać leczeniu BUD/GLY/FORM, aby zapobiec 1 zgonowi (NNT) równą 80††† 14. Dla zobrazowania tej wartości, wypada ona dobrze w porównaniu z NNT uzyskanymi w badaniach statyn 16. Należy przy tym zaznaczyć, że z uwagi na znaczące różnice w konstrukcji badań ETHOS i IMPACT oraz badań w chorobach sercowo-naczyniowych (w tym różny czas trwania, populacje i punkty końcowe), podobne zestawienia NNT mają jedynie charakter obrazowy i nie powinny być traktowane jako dokładne porównania. Co więcej, warto wspomnieć, że ETHOS i IMAPACT wykazały redukcję ryzyka zgonu w porównaniu do mających uzasadnione miejsce w terapii POChP kombinacji LABA/LAMA. Wyżej wspomniane badania UPLIFT, TORCH i SUMMIT wykazały tylko nieistotny trend w porównaniu do placebo 8-10. Wyniki badań ETHOS i IMPACT nie pozostawiają więc wątpliwości, że wziewne leki trójskładnikowe wGKS/LABA/LAMA to skuteczna możliwość redukcji ryzyka zgonu.
Naturalnie pojawiającym się pytaniem jest to, czy redukcja ryzyka zgonu dzięki terapii wGKS/LABA/LAMA to efekt wspólny dla całej klasy tych leków. Odpowiedzi dostarcza zbiorcza analiza post hoc badań TRILOGY, TRINITY i TRIBUTE. Wykazano w niej, że dla kombinacji beklometazon/glikopironium/formoterol nie osiągnięto istotnej redukcji ryzyka zgonu w porównaniu do LABA/LAMA lub LAMA‡ 17. Jest to odzwierciedlone w raporcie GOLD, który uznanie leków wGKS/LABA/LAMA jako jedynej farmakoterapii zmniejszającej śmiertelność w POChP uzasadnia wyłącznie badaniami ETHOS i IMPACT 7. W związku z tym, kolejne pytania warte rozważenia to: które substancje lecznicze, inhalator lub prawdopodobnie połączenie obu tych czynników pozwala na najwyższą redukcję ryzyka zgonu i dlaczego?
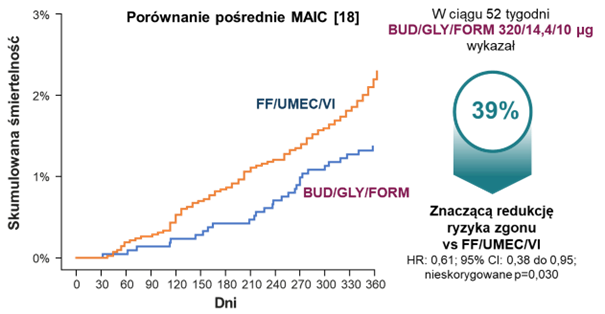
Dotychczas brak badań head-to-head uniemożliwiał dokonania rzetelnego porównania między BUD/GLY/FORM i FF/UMEC/VI. W 2023 r. opublikowana została praca wykorzystująca metodę porównania pośredniego MAIC (ang. matching-adjusted indirect comparison) w celu obiektywnej konfrontacji wyników badań ETHOS i IMPACT. Metoda MAIC pozwala na zniwelowanie czynników utrudniających porównanie osobnych badań, dzięki zapewnieniu podobieństwa zestawianych populacji pacjentów. Polega to na dostosowaniu danych dla populacji pacjentów z jednego badania do populacji z drugiego badania. Proces ten odbywa się na poziomie danych dla pojedynczych uczestników badania i wykorzystuje zmianę wag dla pacjentów, tak by porównywane populacje były ze sobą zgodne na podstawie wybranych cech, np. płci czy statusu palenia. W przypadku leków trójskładnikowych stosowanych w POChP, porównanie MAIC wykazało 39% większą redukcję ryzyka zgonu z jakiejkolwiek przyczyny dla BUD/GLY/FORM w porównaniu do FF/UMEC/VI (HR 0,61; 95% CI 0,38-0,95; p=0,030)‡‡ 18.
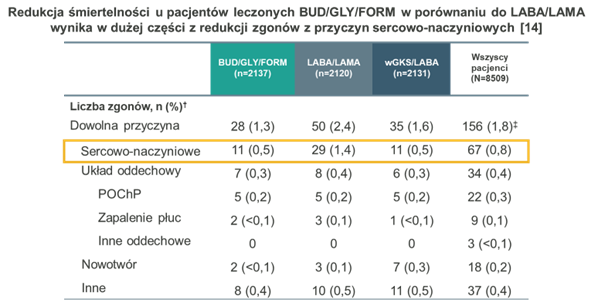
O ile dane, którymi dysponujemy, wskazują na wyższą skuteczność BUD/GLY/FORM, to przyczyny zaobserwowanych różnic nie zostały jeszcze udowodnione. Istnieje jednak kilka kluczowych czynników, które uważa się za najbardziej prawdopodobne. W kontekście substancji leczniczych najważniejsze są różnice we właściwościach fizykochemicznych i farmakologicznych budezonidu i flutykazonu furoinianu. Budezonid jest związkiem mniej lipofilowym, co ułatwia jego klirens w obrębie dróg oddechowych, prowadząc do dwóch ważnych efektów. Po pierwsze, takie właściwości pozwalają na większe działanie przeciwzapalne w obrębie naczyń krwionośnych 19, 20. Może to być szczególnie istotne z uwagi na ryzyko sercowo-płucne w POChP. Świetnie pokazują to dwa duże badania kliniczne w POChP – ETHOS i IMPACT, w których główną przyczyną zgonów były zdarzenia sercowo-naczyniowe (odpowiednio 43% i 30%) 12-15. Po drugie, szybszy klirens budezonidu z dróg oddechowych wiąże się ze zmniejszoną miejscową immunosupresją, co może być ważne w kontekście ryzyka zaostrzeń wywołanych infekcją i ryzyka zapalenia płuc 19. Dotychczas, dowody kliniczne dotyczące ryzyka zapalenia płuc różnych wGKS nie są jednoznaczne – część badań wskazuje na brak istotnych różnic, a inne z kolei pokazują większe bezpieczeństwo mniej lipofilowych wGKS. Do tych ostatnich należy badanie RWE porównujące terapie potrójne wGKS/LABA/LAMA z dwóch inhalatorów, oparte na budezonidzie i flutykazonie, które wykazało istotnie mniejsze ryzyko wystąpienia ciężkiego zapalenia płuc u pacjentów leczonych budezonidem‡‡‡. Dodatkowo, zaobserwowano także mniejsze ryzyko zgonu w grupie przyjmującej budezonid, bez historii wcześniejszych zaostrzeń‡‡‡ 21.
Drugą przyczyną większej redukcji ryzyka zgonu BUD/GLY/FORM może być zastosowanie różnych inhalatorów. Kombinacja FF/UMEC/VI dostępna jest w inhalatorze suchego proszku (DPI) 13, podczas gdy BUD/GLY/FORM w inhalatorze ciśnieniowym (pMDI), wykorzystującym technologię zawiesiny fosfolipidowej 12. W badaniu przeprowadzonym metodą funkcjonalnego obrazowania dróg oddechowych (FRI) wykazano ponad 2 razy większą całkowitą depozycję płucną BUD/GLY/FORM w porównaniu do FF/UMEC/VI i około 5 razy większą depozycję budezonidu w obwodowych drogach oddechowych w porównaniu do flutykazonu furoinianu‡‡‡‡ 22.
Wziewne leki trójskładnikowe wGKS/LABA/LAMA stanowią obecnie ugruntowaną opcję w terapii podtrzymującej POChP. Jest to także jedyna farmakoterapia POChP o udowodnionej redukcji ryzyka zgonu, co podkreśla raport GOLD. Pewne porównanie skuteczności poszczególnych leków trójskładnikowych wymaga dalszych badań i analiz. Nie mniej, dostępne już wyniki dostarczają cennych informacji, które mogą ułatwić racjonalną decyzję o wyborze konkretnego leku w codziennej praktyce klinicznej.
*Tiotropium vs placebo: 14,9% vs 16,5% pacjentów zmarłych w danej grupie. HR 0,89 (95% CI 0,791,02; p=0,09). N = 5993.
**Flutykazonu propionian/salmeterol vs placebo. 12,6% vs 15,2% pacjentów zmarłych w danej grupie. HR 0,825 (95% CI 0,681-1,002; p=0,052). N = 6112.
***Flutykazonu furoinian/wilanterol vs placebo. 6,0% vs 6,7% pacjentów zmarłych w danej grupie. HR 0,88 (95% CI 0,74-1,04; p=0,137). N = 16 485.
†Analiza post hoc badania ETHOS z dodanymi danymi 354 pacjentów, nieuwzględnionych w ETHOS. HR 0,51 (95% CI 0,33-0,80; nieskorygowane p = 0,0035). BUD/GLY/FORM: N = 2137; liczba zgonów: 30 (1,4%). LABA/LAMA: N = 2120; liczba zgonów: 56 (2,6%). Redukcja ryzyka zgonu była drugorzędowym punktem końcowym badania. Wartość p jest nieskorygowana z uwagi na brak istotności statystycznej innego punktu końcowego w hierarchii kontroli błędu typu I.
††Analiza post hoc badania IMPACT z dodanymi danymi 574 pacjentów, nieuwzględnionych w IMPACT. HR 0,72 (95% CI 0,53-0,99; p = 0,042). FF/UMEC/VI: N = 4151; liczba zgonów: 98 (2,36%). LABA/LAMA: N = 2070; liczba zgonów: 66 (3,19%). Redukcja ryzyka zgonu była zdefiniowana jako inny wynik badania (w hierarchii poniżej drugorzędowych punktów końcowych).
†††BUD/GLY/FORM vs GLY/FORM. NNT=80 (95% CI 58-198).
‡HR 0,72 (95% CI 0,49–1,06; p=0,096). Grupa badana: N = 2528; grupa kontrolna: N = 1844.
‡‡Nie istnieją bezpośrednie badania porównawcze między tymi dwoma lekami. Z uwagi na ograniczenia porównań pośrednich i różnice między populacjami w badaniach ETHOS i IMPACT, wykonano porównanie pośrednie MAIC (ang. matching-adjusted indirect comparison) na podstawie badań ETHOS i IMPACT. Hazard względny (HR) 0,61 (95% CI 0,38-0,95; p = 0,030). Wartość p jest nieskorygowana z uwagi na brak istotności statystycznej innego punktu końcowego w hierarchii kontroli błędu typu I. Leczenie BUD/GLY/FORM zostało dostosowane (na podstawie ogólnych danych FF/UMEC/VI z badania IMPACT) pod kątem płci, rasy oraz wyjściowego wskaźnika masy ciała, statusu palenia, historii ciężkich zaostrzeń w ciągu ostatnich 12 miesięcy, wyników próby rozkurczowej i nasilenia POChP. Analiza obejmowała dane z okresu leczenia i poza nim w ostatecznie pozyskanych zbiorach danych z populacji ITT, w tym indywidualne dane na poziomie pacjenta z badania ETHOS i pseudoindywidualne dane na poziomie pacjenta pozyskane z elektronicznej wersji krzywych Kaplana-Meiera z badania IMPACT.
‡‡‡Ryzyko ciężkiego zapalenia płuc: HR 0,84 (95% CI 0,75-0,95). Ryzyko zgonu: HR 0,80 (95% CI 0,660,98). N = 39 362.
‡‡‡‡Całkowita depozycja płucna: BUD/GLY/FORM 47,0-54,1%, FF/UMEC/VI 20,8-22,7%. Depozycja wGKS w obwodowych drogach oddechowych: BUD/GLY/FORM 16,1%, FF/UMEC/VI 3,3%. Badanie przeprowadzone metodą funkcjonalnego obrazowania dróg oddechowych (FRI). Wykorzystane zostały trójwymiarowe modele dróg oddechowych 20 chorych na POChP (średni wiek (±SD), 64,65 (±8,27) lat; średnia FEV1 (±SD) 1,27 (±0.59) L). Całkowita i regionalna depozycja płucna została wyrażona jako odsetek dawki dostarczonej BUD/GLY/FORM w inhalatorze ciśnieniowym w dawce 160/7,2/5 μg na inhalację i kombinacji furoinian flutykazonu/umeklidynium/wilanterol FF/UMEC/VI w inhalatorze suchego proszku, w dawce 100/62,5/25 μg. Symulacje zostały wykonane, korzystając z 4 profili inhalacji dla BUD/GLY/FORM i 2 profili dla FF/UMEC/VI. Profile różniły się czasem trwania i przepływem wdechowym w celu odzwierciedlenia różnych stopni nasilenia choroby oraz obsługi inhalatora, włączając wspólny profil ze średnią wartością przepływu wdechowego 69 L/min, który jest bardziej odpowiedni dla inhalatorów suchego proszku. Oszacowano depozycję płucną leków trójskładnikowych jako całości, a także dla każdego składnika z osobna.
BUD, budezonid
CI, przedział ufności
DPI, inhalator suchego proszku
FF, flutykazonu furoinian
FORM, formoterol
FRI, funkcjonalne obrazowanie dróg oddechowych
GLY, glikopironium
HR, hazard względny
MAIC, porównanie pośrednie z dostosowaniem do grupy porównawczej
LABA, długo działający β2-agonista
LAMA, długo działający antagonista receptora muskarynowego
NNT, liczba pacjentów, których należy poddać leczeniu, aby pożądany efekt wystąpił u 1 pacjenta pMDI, inhalator ciśnieniowy z dozownikiem
POChP, przewlekła obturacyjna choroba płuc
RCT, randomizowane badanie kliniczne
RWE, badanie w warunkach rzeczywistej praktyki klinicznej
SD, odchylenie standardowe
UMEC, umeklidynium
VI, wilanterol
wGKS, wziewny glikokortykosteroid
1. GBD 2021 Forecasting Collaborators. Lancet. 2024;403(10440):2204-2256.1.
2. WHO. Chronic obstructive pulmonary disease (COPD) (16.03.2023).
https://www.who.int/news-room/fact-sheets/detail/chronic-obstructive-pulmonary- disease-(copd) (data dostępu: 13.11.2024).
3. Hurst JR et al. N Engl J Med. 2010;363:1128-1138.
4. Kunisaki KM, et al. Am J Respir Crit Care Med. 2018;198(1):51-57.
5. Hurst JR, et al. Eur J Intern Med. 2020;73:1-6.
6. Mannino DM, et al. Respir Med 2006;100:115–122.
7. WHO. Chronic obstructive pulmonary disease (COPD) (16.03.2023).
https://www.who.int/news-room/fact-sheets/detail/chronic-obstructive-pulmonary- disease-(copd) (data dostępu: 13.11.2024).
8. Tashkin DP, et al. N Engl J Med 2008; 359:1543-1554.
9. Calverley PM, et al. N Engl J Med. 2007;356(8):775-789.
10. Vestbo J, et al. Lancet. 2016;387(10030):1817-1826.
11. Global Strategy for the Diagnosis, Management, and Prevention of Chronic Obstructive Pulmonary Disease: 2023 Report. https://goldcopd.org/archived-reports/ (data dostępu: 25.01.2024).
12. Rabe KF et al. N Engl J Med. 2020;383:35-48.
13. Lipson DA, et al. N Engl J Med 2018;378:1671–1680.
14. Martinez FJ, et al. Am J Respir Crit Care Med. 2021;203(5):553-564.
15. Lipson DA, et al. Am J Respir Crit Care Med. 2020;201(12):1508-1516.
16. Cheung BM, et al. Br J Clin Pharmacol. 2004;57(5):640-651.
17. Vestbo J, et al. Eur Respir J. 2018;52(6):1801230.
18. Stolz D, et al. Curr Med Res Opin. 2023;1-17.
19. Sin DD, et al. Lancet. 2009;374(9691):712-719.
20. Brattsand R, et al. Pulm Pharmacol Ther. 2022;77:102167.
21. Suissa S, et al. COPD. 2022;19(1):109-117.
22. Usmani O, et al. Respir Res. 2023;24(1):226.
23. Aktualna Charakterystyka Produktu Leczniczego Trixeo Aerosphere.